Terapia simple de genes restaura la vista
Genes reparados pueden ahora insertarse sin riesgo en fotorreceptores en la fóvea
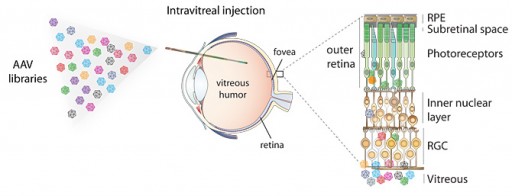
Para hacer evolucionar un virus mejor adaptado para la terapia genética, investigadores de UC Berkeley crearon más de 100 millones de virus adeno-asociados (izquierda) y los inyectaron en el centro gelatinoso del ojo. Esos que pudieron penetrar las múltiples capas de células en la retina son utilizados para suministrar genes correctivos en las células que contienen genes defectuosos. Para llegar a estas células, en particular las fotorreceptoras sensibles a la luz y del epitelio pigmentario de la retina, los virus deben pasar a través de múltiples capas celulares (derecha). (Crédito: UC Berkeley)
Investigadores de la Universidad de California, Berkeley, han desarrollado un nuevo método para insertar genes en las células de la retina que resulta más fácil y más efectivo que métodos anteriores. Este nuevo método podría expandir grandemente la terapia de genes para ayudar a restaurar la vista en pacientes con enfermedades de la vista que van desde defectos heredados, como la renitis pigmentosa, a enfermedades degenerativas relativas a la edad, como la degeneración macular.
A diferencia de los tratamientos actuales, el nuevo procedimiento suministra genes a células muy difíciles de alcanzar en toda la retina.
En los últimos seis años, tres grupos de investigadores han restaurado parcialmente con éxito la visión a más de una docena de personas que padecen una enfermedad rara de los ojos llamada Amaurosis congénita de Leber, que ocasiona una pérdida completa de la vista en la madurez temprana, por medio de la inyección de virus con gen normal directamente en la retina de un ojo con gen defectuoso.
Esto es posible al insertar este gen corrector en virus adeno-asociados (AAV por sus siglas en inglés) y proceder a inyectar estos virus comunes benignos modificados directamente en la retina.
Las células fotorreceptoras toman los virus y los incorporan en los cromosomas del gen funcional para fabricar una proteína crítica que el gen defectuoso es incapaz de crear, rescatando así los fotorreceptores y restaurando la vista.
Sin embargo, incluso con los métodos más invasivos, el virus y su gen asociado no lograban llegar a todas las células de la retina que requerían reparación. La técnica no puede ser aplicada en la mayoría de enfermedades de la vista ya que la aguja ocasiona a menudo desprendimiento de retina, lo que empeora las cosas.
También, el estándar AVV utilizado en los ojos y otras terapias genéticas no puede penetrar en el tejido para alcanzar los fotorreceptores y otras células, tales como el epitelio pigmentario de la retina, que requiere también ser reparado. La retina es alrededor 100,000 veces más gruesa que el diámetro del AAV, que es de 20 nanómetros.
Adicionalmente, “introducir una aguja a través de la retina para inyectar el virus modificado detrás de ella es un procedimientos quirúrgico riesgoso”, indicó David Schaffer, profesor de UC Berkeley.
“Pero los médicos no tienen elección, ya que ninguno de los virus utilizados para terapia genética puede viajar hasta el fondo del ojo y llegar a los fotorreceptores –células sensibles a la luz que requieren el gen terapéutico”.
Hace algunos años, Schaffer inició a investigar cómo los AAV serían capaces de penetrar los tejidos, incluyendo el ojo y el hígado, como una forma de suministrar genes a células específicas.
En la actualidad, ha generado más de 100 millones de variantes de AAV –cada uno con una cubierta ligeramente distinta de proteínas– y entre los cuales él y sus colegas seleccionaron cinco que mostraron ser capaces de penetrar la retina.
“Basados en 14 años de investigación, hemos creado ahora un virus que sólo inyectas en humor vítreo líquido dentro del ojo y es capaz de suministrar el gen modificado a células retinales de muy difícil alcance de una manera segura y no invasiva. Es un procedimiento de 15 minutos y puedes irte a casa ese mismo día”.
Cuando se inyectó en el ojo de un mono sano, el AVV suministró el gen correctivo en todas las áreas de la retina y restauró las células retinales a un funcionamiento casi normal.
El virus penetró las células salteadamente a través de la retina, pero casi penetró por completo en el área llamada fóvea, que es en extremo importante para la visión fina. (Los virus actuales no logran penetrar esa área).
El virus modificado trabaja mucho mejor que las actuales terapias en modelos roedores de dos enfermedades degenerativas del ojo y puede penetrar células fotorreceptoras en los ojos de monos, muy similares a los de los humanos.
Schaffer indicó que su equipo está ya colaborando con médicos para identificar a pacientes que podrían beneficiarse de esta técnica de suministro de genes y, después de pruebas de desarrollo pre-clínico, esperan pronto iniciar las pruebas clínicas en humanos.
Schaffer predice que los virus pueden no sólo ser utilizados para restaurar una función de genes que no operan apropiadamente, sino pueden parar o detener genes que están activamente arruinando las células retinales, lo que puede ser el caso en la degeneración macular relacionada con la edad.
“Cuando llegué aquí hace 14 años, tenía el objetivo de hacer algo que realmente tuviera un impacto en la salud, y creo que estamos allí ahora”, dijo Schaffer.
Más información aquí.


Comentarios